流行性出血热
概述:流行性出血热(epidemic hemorrhagic fever,EHF)是一种由病毒传染的自然疫源性疾病,流行广泛,危害严重。至今,流行性出血热还是一种严重危害我国广大人民群众健康的传染性疾病。
流行性出血热在不同的国家和地区,由于其病原、流行病学及临床特征不同,曾有过多种不同的名称。如我国和日本将其称之为“流行性出血热”;朝鲜称之为“朝鲜出血热”;苏联称之为“出血性肾炎肾病”;北欧称之为“流行性肾病”等。实际上,不同国家和地区的流行性出血热,无一例外地都有不同程度的肾脏损害,故1982年世界卫生组织(WHO)统一将其命名为“肾综合征出血热”(hemorrhagic fever withrenal syndrome,HFRS)。
 流行病学
流行病学
流行病学:本病是世界性流行疾病,目前世界上有31个国家和地区流行本病。但主要流行于亚洲的我国和韩国,次为欧洲的俄罗斯、芬兰和前南斯拉夫等国。非洲和美洲的病例较少,在世界各国中我国是重疫区,20世纪50年代报告病例为数以百计,60年代数以千计,70年代则数以万计,80年代高达10万计。通过灭鼠等防治措施,以及农民住房条件的改善,90年代以来发病人数有所下降。目前除青海和新疆尚未发现病例外,其余30个省市、自治区均有病例报告,包括台湾。
1.宿主动物与传染源 根据国内外不完全统计有170多种脊椎动物自然感染汉坦病毒属病毒。我国发现53种动物携带流行性出血热病毒。主要宿主动物是啮齿类,其他动物包括狗、猫、家兔、野兔等,一般认为这类动物多为继发感染。不同地区主要宿主动物和传染源不尽相同,我国主要以黑线姬鼠、褐家鼠为主要宿主动物和传染源;其次为大林姬鼠、小家鼠和实验用的大白鼠。我国的山西、河南和城市疫区以褐家鼠为主要传染源。林区以大林姬鼠、农村以黑线姬鼠为主要传源。北欧及俄罗斯欧洲部分以棕背

、东欧以黄喉姬鼠、朝鲜以黑线姬鼠和褐家鼠、日本以褐家鼠和大白鼠为主要传染源。
由于流行性出血热患者早期的血和尿液中携带病毒,虽然有个别病例接触后感染本病的报告,但人不是主要传染源。
2.传播途径
(1)呼吸道传播:鼠类携带病毒的排泄物如尿、粪、唾液等污染尘埃后形成的气溶胶,能通过呼吸道传播而引起人体感染。国内有多例实验人员经呼吸道传播而感染的事例。此外,亦有报告从流行性出血热实验动物房的空气中分离出流行性出血热病毒。
(2)消化道传播:进食被鼠类排泄物所污染的食物,可经口腔或胃肠道黏膜而感染。
(3)接触传播:被鼠咬伤和破损伤口接触带病毒的鼠类排泄物或血液后亦可导致感染。
(4)垂直传播:孕妇感染本病后,病毒可以经胎盘感染胎儿。曾从感染流行性出血热孕妇的流产胎儿脏器中,分离到流行性出血热病毒。
(5)虫媒传播:尽管我国从恙螨中分离到流行性出血热病毒,但尚有待进一步证实其传播作用。
3.人群易感性和免疫力 人群普遍易感,在流行区隐性感染率可达3.5%~4.3%。HTNV感染患者特异性IgG抗体可维持1~30年,SEOV感染者IgG抗体多数在2年内消失。HTNV感染后对SEOV有一定交叉免疫力,SEOV感染者对HTNV的免疫力不强。
4.流行的季节性和周期性 本病虽然四季均能发病,但有明显高峰季节,其中姬鼠传播者以11~1月为高峰,5~7月为小高峰。家鼠传播者以3~5月为高峰,林区姬鼠传播者以夏季为流行高峰。
本病发病率有一定周期性波动,以姬鼠和棕背鼠平为主要传染源的疫区,一般相隔数年有一次较大流行,家鼠为传染源的疫区,周期尚不明显。国内外研究证明,流行高峰之前,主要传染源密度增高,带病毒率也增高。
 病因
病因
病因:流行性出血热的病原是布尼亚病毒科(Bunyav’iridae)的汉坦病毒属(Hanta virus,HV)病毒。能引起肾综合征出血热的病原包括汉坦病毒属的汉坦病毒(Hantaan virus,HTNV)、汉城病毒(Seoul virus,SEOV)、普马拉病毒(Puumala virus,PUUV),以及贝尔格莱德-多布拉伐病毒(Belgrade-Dobrava virus,BDOV)等型。我国的流行性出血热主要是汉坦病毒和汉城病毒所引起。普马拉病毒主要在欧洲引起流行性肾病(nephropathic epidemica,NE)。贝尔格莱德-多布拉伐病毒在东南欧引起较重型HFRS。
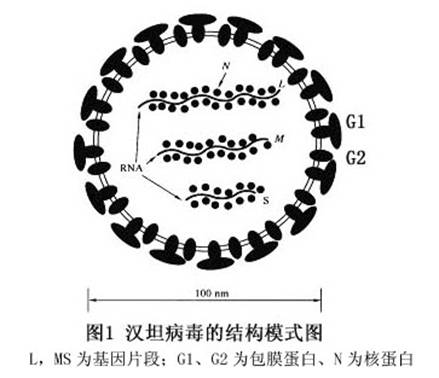
流行性出血热病毒为单股负链RNA病毒,形态呈圆形或卵圆形,有双层包膜,外膜上有纤突。平均直径为120 nm,其基因RNA可分为大、中、小三个片段,即L、M和S。分子量分别为2.7×106,1.2×106和0.6×106。指纹图谱分析表明病毒RNA的三个片段都是独特的,不同病毒株有差异,其中S基因含1696个核苷酸,编码核壳蛋白(含核蛋白NP)。M基因含3616个核苷酸,编码包膜糖蛋白,可分为G1和G2。1基因编码聚合酶,含6533个核苷酸。核壳蛋白(含核蛋白NP)是病毒的主要结构蛋白之一,它包裹着病毒的各基因片段。G1和G2糖蛋白构成病毒的包膜(图1)。
我国分离的汉坦病毒A9株的M和S基因片段核苷酸序列与代表株76-118株的核苷酸同源性为84.57%,氨基酸的同源性为96.83%。汉城病毒R22、HB55株与代表株Seoul。80~39株的核苷酸同源性分别为95.3%和95.6%,氨基酸的同源性分别为98.9%和99.4%。近年来我国发现HTNV至少有八个亚型,SEOV有六个亚型。甚至还发现新的基因型病毒,这可能与汉坦病毒间基因重排有关。实验已证实汉坦病毒与汉城病毒间可以发生基因重排。
流行性出血热病毒的核蛋白有较强的免疫原性和稳定的抗原决定簇,一般认为核蛋白中含补体结合抗原,而不含中和抗原。宿主感染后核蛋白抗体出现最早,病程第2~3天即能检出,有利于早期诊断。膜蛋白中含中和抗原和血凝抗原,但组特异性中和抗原和血凝抗原主要存在于G2蛋白上。由于膜蛋白中具有血凝活性,可产生低pH依赖性细胞融合,这种功能可能对病毒颗粒黏附于受感染宿主的细胞表面及随后病毒脱核壳进入胞质起重要作用。
不同宿主携带的病毒致病力相差极大,这与宿主动物的类别有关。近年来越来越多的资料表明,每种已知的汉坦病毒都主要与单一鼠种相联系,有的称之为“原始宿主"。各种汉坦病毒与其特有的原始宿主间存在着一个长期共演化的关系。Jeor等曾反复捕捉和释放接种汉坦病毒的同一啮齿动物,观察其体内的自然带毒情况,结果发现同一株病毒在同一类啮齿类动物中,在整个捕捉和释放两次或以上过程中,分离到的病毒基因不论是M片段、S片段或非编码区片段均完全一致,但在不同种的啮齿动物接种同一株病毒,以上基因片段的序列则有改变。Kariwa等也发现不同年代从捕获褐家鼠中分离的Seoul病毒株,其G1和G2氨基酸同源性大于99.7%。证明汉坦病毒有其特殊的宿主动物依赖性。其次,汉坦病毒的毒力也与病毒本身的基因有关,主要是M片段编码的产物,糖蛋白I(G1)和糖蛋白2(G2)。不同血清型的汉坦病毒,G1编码区同源性低于G2,抗G1的McAb与各血清型病毒间的交叉反应明显少于G2,表明G1区是编码型特异性的抗原决定簇,而G2为组特异性抗原决定簇。在布尼亚病毒G1是决定病毒毒力和感染性的主要因素,同型病毒间基因片段经过重排(rearrangment)形成的病毒变异,病毒蛋白质糖基化方式的改变及基因突变均可引起病毒毒力的改变。此外,人的基因也在病毒和机体互相作用中起重要作用。Mustonen等检测了NE患者的HLA分型,发现重型患者HLA-B8和DRBI0301等位基因检出率,明显要高于对照组。其中休克患者检出率为100%(7/7),因急性肾衰竭需进行透析者13例,其中HLA-B8阳性9例(69%),DRBI0301阳性者8例(62而对照组却为15%,汉坦病毒类等位基因可能导致感染汉坦病毒者增强或引起异常的免疫应答有关。
流行性出血热病毒对乙醚、氯仿、丙酮等脂溶剂和去氧胆盐敏感,4~20℃温度下相对稳定,高于37℃及pH5.0以下易灭活。56℃ 30min或100℃ 1min可灭活。对紫外线、乙醇和碘酒敏感。
 发病机制
发病机制
发病机制:
1.发病机制 本病的发病机制至今仍未完全清楚,多数研究提示:汉坦病毒是本病发病的始动因子。一方面病毒感染能导致感染细胞功能和结构的损害;另一方面病毒感染诱发人体的免疫应答和各种细胞因子的释放,既有清除感染病毒,保护机体的作用,又能引起机体组织损伤的不利作用。
一般认为汉坦病毒进入人体后随血流到达全身,病毒首先与血小板、内皮细胞和单核细胞表面表达的受体p3整联蛋白相结合,然后进入细胞内以及肝、脾、肺、肾等组织,进一步复制后再释放进入血流,引起病毒血症,由于病毒感染和感染后诱发的免疫反应,以及多种细胞因子的释放,导致细胞变性、坏死或凋亡,因而器官功能受损。由于汉坦病毒对人体呈泛嗜性感染,因而能引起多器官损害。细胞和器官损害的机制包括:
(1)病毒直接作用:主要依据是:
①临床上患者有病毒血症期,且有相应的中毒症状。
②不同血清型的病毒,所引起的临床症状轻重也不同。它对乳鼠的致病力也不同。说明EHF患者发病后临床症状的轻重与病毒抗原的差异和毒力强弱密切相关。
③EHF患者几乎在所有脏器组织中均能检出汉坦病毒抗原,尤其是EHF基本病变部位血管内皮细胞中。而且有抗原分布的细胞,往往发生病变。
④体外培养的正常人骨髓细胞和血管内皮细胞,在排除细胞免疫和体液免疫作用的情况下,感染EHF病毒后,出现细胞膜和细胞器的损害,说明细胞损害是汉坦病毒直接作用的结果。
(2)免疫作用:
①免疫复合物引起的损伤(Ⅲ型变态反应):本病患者早期血清补体下降,血循环中存在特异性免疫复合物。近年来还发现患者皮肤小血管壁、肾小球基底膜、肾小管和肾间质血管有免疫复合物沉积,免疫组化方法证明抗原是EHF病毒抗原,同时存在补体裂解片段,故认为免疫复合物是本病血管和肾脏损害的原因。
②其他免疫反应:EHF病毒侵入人体后,可引起机体一系列免疫应答,目前发现:
A.本病早期特异性IgG抗体升高,其上升水平与肥大细胞脱颗粒阳性率呈正相关,提示存在着Ⅰ型变态反应。
B.EHF患者血小板中存在免疫复合物,电镜观察肾组织除颗粒状IgG沉着外,肾小管基底膜存在线状IgG沉积,提示临床上血小板的减少和肾小管的损害与Ⅱ型变态反应有关。
C.电镜观察发现淋巴细胞攻击肾小管上皮细胞,认为病毒可以通过细胞毒T细胞的介导损伤机体细胞。提示存在Ⅳ型变态反应。至于以上存在的Ⅰ、Ⅱ、Ⅳ型变态反应在本病发病机制中的地位,尚有待进一步研究。
(3)各种细胞因子和介质的作用:汉坦病毒能诱发机体的巨噬细胞和淋巴细胞等释放各种细胞因子和介质,如白细胞介素-1(IL-1)、TH1类细胞因子IFN-r、IL-2、肿瘤坏死因子α(TNF-α)、TH2类细胞因子IL-10等,引起临床症状和组织损害。如IL-1和TNF能引起发热。一定量的TNF能引起休克和器官功能衰竭。此外,血浆内皮素(endotheliolysin)、血栓烷B2、血管紧张素Ⅱ等的升高能显著减少肾血流量和肾小球滤过率,促进肾衰竭的发生。
2.病理和生理 本病病理变化以小血管和肾脏病变最明显,其次为心、肝、脑等脏器。
EHF基本病变是小血管(包括小动脉、小静脉和毛细血管)内皮细胞肿胀、变性和坏死。管壁呈不规则收缩和扩张,最后呈纤维素样坏死和崩解。管腔内可有微
血栓形成,由于广泛性小血管病变和血浆外渗,使周围组织水肿和出血。肾脏肉眼可见肾脂肪囊水肿、出血。肾皮质缺血而苍白、肾髓质极度充血并有出血和水肿。镜检可见肾小球充血、基底膜增厚,肾近曲小管变性和肾小管受压而变窄或闭塞,肾间质有细胞浸润。电镜观察,肾小球毛细血管内皮细胞有不同程度的肿胀,少尿期病例的个别肾小球见毛细血管内皮细胞坏死,管嗜中性粒细胞及血小板,内皮细胞与基底膜间充以低电子密度的物质。腔内有心脏病变主要是右心房内膜下广泛出血,心肌纤维有不同程度的变性、坏死,部分可断裂。腺垂体显著充血、出血和凝固性坏死。神经垂体无明显变化。
(1)休克:本病病程第3~7天常出现
低血压休克称为原发性休克。少尿期以后发生的休克称为继发性休克。原发性休克的原因主要由于全身小血管广泛受损,血管通透性增加,血浆大量外渗于疏松组织中,如腹膜后及脏器软组织中,使血容量下降。此外由于血浆外渗使血液浓缩,血液黏稠度升高能促进弥散性血管内凝血(DIC)的发生,导致血液循环淤滞,血流受阻,因而进一步降低有效血容量。继发性休克的原因主要是大出血、继发感染和多尿期水与电解质补充不足,导致有效血容量不足。
(2)出血:EHF患者出血的因素较为复杂,有时是多种因素参与。一般认为发热期皮肤、黏膜的小出血点是毛细
血管损伤,血小板减少和血小板功能异常所致。
低血压休克期至多尿前期,主要是DIC导致凝血机制异常,此外血小板减少和功能障碍,肝素类物质增加和尿毒症等亦能导致出血。
①小
血管损伤:EH患者小血管的病变主要表现为内皮细胞肿胀和退行性变,严重者出现纤维蛋白样坏死,甚至血管壁崩解。可导致大量血液渗出和出血。目前认为小血管受损的原因有三:
A.汉坦病毒直接作用于血管内皮细胞,使之受损。
B.汉坦病毒抗原与抗体复合物沉着于小血管,在补体参与下吸引中性粒细胞吞噬抗原抗体复合物,并释放溶酶体中的蛋白水解酶,从而损伤内皮细胞。
C.由于休克及其他原因所致的微循环障碍,使血管内皮细胞缺氧而导致变性坏死。
②血小板减少和功能障碍:正常情况下血小板沿着血管壁排列成行,具有保持毛细血管完整性,减低毛细血管脆性和通透性的作用。血小板的减少导致毛细血管脆性和通透性的增加,此外由于血小板的黏附、凝聚及释放功能的障碍,从而影响血液凝固。EHF患者血小板减少与骨髓巨核细胞成熟障碍,血小板消耗增加和破坏增多有关。
③凝血机制的异常:由于DIC消耗了大量凝血因子,此外DIC引起继发性纤溶亢进,使纤维蛋白原降解产物增多,以及肝素类物质增加等均能引起凝血异常。
A.DIC原因:EHF患者DIC发生率可达35%~70%,除恢复期外其余各期均可发生,尤以
低血压休克期和少尿期多见。这是EHF病毒或免疫复合物损伤了毛细血管或小血管内皮细胞,导致血管基底膜胶原的暴露,从而激活因子Ⅻ,导致连锁反应引起内源性凝血。此外EHF患者血浆外渗,血液浓缩和黏滞性增加,以及休克和少尿期的酸中毒,均有促进DIC的作用。
B.肝素类物质增加:80%左右EHF患者从发热期开始血中肝素类物质增高。除体内肥大细胞等释放增加外,因肝脏受损对肝素灭活减少、肾衰竭使肝素排泄减少以及血浆蛋白大量外渗与肝素结合减少,均促使游离肝素增加。
(3)急性肾衰竭:其原因包括:
①肾血流障碍:由于血浆外渗,血容量减少和血液浓缩,血流量不足,以致肾小球滤过率急剧下降。
②肾脏的免疫损伤:已证实肾小球基底膜和肾小管基底膜存在免疫复合物的沉积,经激活补体后可使肾小球基底膜和肾小管上皮细胞受损。细胞毒性T细胞亦能引起肾小管受损。
③间质水肿和出血:血浆外渗引起的肾间质水肿,以及肾髓质充血、出血压迫肾小管,可使尿量减少。
④肾缺血性坏死
低血压休克和DIC导致肾血管微
血栓形成,均能使肾实质细胞产生缺血性坏死。
⑤肾素、血管紧张素Ⅱ的激活:使肾动脉收缩,因而肾皮质血流减少,肾小球滤过率下降。
⑥肾小管管腔阻塞:肾小管管腔可被蛋白、管型等阻塞,尿液排出受阻。
 临床表现
临床表现
临床表现:在肾综合征出血热中以汉坦病毒和贝尔格莱德-多布拉伐病毒引起者症状较重,而汉城病毒引起者次之,普马拉病毒引起者症状较轻。
1.临床分期 本病潜伏期4~46天,一般为7~14天,以2周多见。典型病例病程中有发热期、
低血压休克期、少尿期、多尿期和恢复期的五期经过。非典型和轻型病例可出现越期现象,而重症患者则出现发热期、休克和少尿期之间的重叠。
(1)发热期:除发热外主要表现有全身中毒症,毛细
血管损伤和肾损害征。
①发热: 少数患者起病时以低热、胃肠不适和呼吸道感染样前驱症状开始。多数患者突然起病有畏冷、发热,体温39~40℃之间,以稽留热和弛张热多见,热程多数为3~7天,少数达10天以上。一般体温越高、热程越长,则病情越重。轻型患者热退后症状缓解,重症患者热退后病情反而加重。
②全身中毒症:多数患者出现全身酸痛、
头痛和腰痛。少数患者出现眼眶疼痛并以眼球转动时为甚。
头痛、腰痛、眼眶痛一般称为“三痛”。
头痛为脑血管扩张充血所致;腰痛为肾周围组织充血、水肿以及腹膜后水肿有关;眼眶痛是眼球周围组织水肿所致,重者可伴有眼压升高和视力模糊。
多数患者可以出现胃肠中毒症状,如食欲减退、恶心、呕吐、呃逆,亦可有
腹痛、
腹泻。
腹痛剧烈者,腹部有压痛、反跳痛,易误诊为急腹症而进行手术。此类患者多系肠系膜局部极度充血和水肿所致。
腹泻可带黏液和血,易误诊为肠炎或
痢疾。
部分患者可出现嗜睡、烦躁、
谵妄或抽搐等神经精神症状,此类患者多数发展为重型。
③毛细血管损害征:主要表现为充血、出血和渗出水肿。皮肤充血主要见于颜面、颈、胸等部潮红,重者呈酒醉貌。黏膜充血见于眼结膜、口腔的软腭和咽部。皮肤出血多见于腋下及胸背部,常呈搔抓样,条索点状瘀点,黏膜出血常见于软腭呈针尖样出血点,眼结膜呈片状出血。少数患者有鼻出血、
咯血、黑便或血尿。如在病程第4天至第6天,腰、臀部或注射部位出现大片瘀斑,可能为DIC所致,此是重症表现。渗出水肿征主要表现在球结膜水肿,轻者眼球转动时球结膜似涟漪,重者球结膜呈水泡样,甚至突出眼裂。部分患者出现眼睑和脸部水肿,亦可出现
腹水。一般渗出水肿征越重,病情越重。
④肾损害:主要表现尿蛋白阳性,镜检可发现管型等。
(2)
低血压休克期:一般发生于第4~6病日,迟者可于第9病日左右出现。多数患者在发热末期或热退同时出现血压下降。少数在热退后发生休克,这是与细菌性感染不同之处。
低血压或休克持续时间,短者数小时,长者可达6天以上,一般为1~3天。其持续时间的长短与病情轻重、治疗措施是否及时和正确有关。多数患者开始出现血容量不足时,能通过神经体液调节,使皮肤、内脏血管收缩,而维持正常血压,此时由于儿茶酚胺分泌增加,可使心跳增快。当血容量继续下降,则出现
低血压,甚至休克。此时出现脸色苍白,四肢厥冷,脉搏细弱或不能触及,尿量减少等。当大脑供血不足时,可出现烦躁、
谵妄、神志恍惚。轻型患者可不发生
低血压或休克。少数顽固性休克患者,由于长期组织血流灌注不良,而出现发绀,并促使DIC、脑水肿、急性呼吸窘迫综合征和急性肾衰竭的发生。此时患者出现呼吸急促,
昏迷,抽搐和广泛出血。
(3)少尿期:少尿期是继
低血压休克期而出现,部分患者临床上没有明显
低血压休克期,由发热期直接进入少尿期。亦有少尿期与
低血压休克期重叠者,此时应和肾前性少尿相鉴别。一般认为尿量<500ml/24h为少尿,<50m1/24h为无尿。少数患者无明显少尿而存在氮质血症,称为无少尿型肾功能不全,这是肾小球受损而肾小管受损不严重,只影响肾小球对肌酸酐和尿素氮的排泄。少尿期一般发生于第5~8病日,持续时间短者1天,长者10余天,一般为2~5天。
尿中有膜状物排出者为重症。少尿期的临床表现为尿毒症、酸中毒和水、电解质紊乱。严重患者可出现高血容量综合征和
肺水肿。
①尿毒症:由于尿素氮和氨类刺激作用可出现厌食、恶心、呕吐,
腹胀、
腹泻和口腔溃疡等胃肠症状。常有顽固性呃逆,可出现头昏、
头痛、烦躁、嗜睡、
谵妄,甚至
昏迷、抽搐等神经症状。多数患者此期由于血小板减少和功能障碍,肝素类物质增加或DIC等而使出血现象加重。表现在皮肤瘀斑增加、鼻出血、
便血、呕血、
咯血、血尿和阴道出血。少数患者尚可出现颅内出血或其他内脏出血。
②酸中毒:由于酸性代谢物质的蓄积而出现
代谢性酸中毒,表现为呼吸增快或库斯莫尔(Kussmaul)大呼吸。
③水和电解质紊乱:由于水、钠潴留,使组织水肿加重,患者可出现颜面、四肢水肿,甚至出现
腹水。此期电解质紊乱主要是高血钾,稀释性低血钠和低血钙。少数患者亦可发生低血钾和高血镁。由于低血钾和高血钾均能引起
心律失常,因此宜定期检测血清钾和心电图予以鉴别。低血钠主要表现为头昏、倦怠,严重者出现视力模糊和脑水肿症状。低血钙可引起手足搐搦。
④高血容量综合征:表现为体表静脉充盈,收缩压增高,脉压增大因而脉搏洪大。脸部胀满和心率增快。
本期病情轻重与少尿持续时间和氮质血症的高低相平行。若尿素氮上升2 1mmol/(L·d)以上,为高分解型肾衰竭,预后较差。
(4)多尿期:此期为新生的肾小管重吸收功能尚未完善,加以尿素氮等潴留物质引起高渗性利尿作用,使尿量明显增加。多数患者少尿期后进入此期,少数患者可由发热期或
低血压期转入此期。多尿期一般出现在病程第9~14天,持续时间短者1天,长者可达数月之久。根据尿量和氮质血症情况可分为三期。
①移行期:尿量由500ml/d增至2000ml/d,此期虽尿量增加但尿素氮和肌酸酐等反而升高,症状加重,不少患者因并发症而死于此期,宜特别注意观察病情。
②多尿早期:尿量超过2000ml/d,氮质血症未见改善,症状仍重。
③多尿后期:尿量超过3000ml/d,并逐日增加,氮质血症逐步下降,精神食欲逐日好转。此期尿量可达4000~8000ml/d,少数可达15000ml/d以上。
此期若水和电解质补充不足或继发感染,可发生继发性休克,亦可发生低血钠、低血钾等症状。
(5)恢复期:经多尿期后,尿量恢复为2000ml/d左右,精神、食欲基本恢复。一般尚需1~3个月,体力才能完全恢复。少数患者可遗留高血压、肾功能障碍、心肌劳损和垂体功能减退等症状。
2.临床分型 根据发热高低、中毒症状轻重和出血、休克、肾功损害严重程度的不同,临床上可分为5型。
(1)轻型:体温39℃以下,中毒症状轻,除出血点外无其他出血现象。肾损害轻,无休克和少尿;
(2)中型:体温39~40℃,中毒症状较重,有明显球结膜水肿,病程中收缩压低于12kPa(90mmHg)或脉压小于3.5kPa(26mmHg)。有明显出血及少尿期,尿蛋白 ;
(3)重型:体温≥40 ℃,中毒症及渗出征严重,可出现中毒性精神症状,并出现休克,有皮肤瘀斑和腔道出血。少尿持续5天以内或无尿2天以内;
(4)危重型:在重型基础上并出现以下之一情况者。①难治性休克;②有重要脏器出血;③少尿超出5天或无尿2天以上,BUN>42.84mmol/L;④出现心力衰竭、
肺水肿;⑤出现脑水肿、
脑出血或脑疝等中枢神经合并症;⑥严重继发感染;
(5)非典型:发热38℃以下,皮肤黏膜可有散在出血点,尿蛋白±,血、尿特异性抗原或抗体阳性者。
 并发症
并发症
并发症:
1.腔道出血 呕血、
便血最为常见,可引起继发性休克。腹腔出血、鼻腔和阴道出血等均较常见。
2.中枢神经系统并发症 包括发病早期因病毒侵犯中枢神经而引起脑炎和
脑膜炎,休克期和少尿期因休克、凝血功能障碍、电解质紊乱和高血容量综合征等引起的脑水肿,高血压脑病和颅内出血等,可出现
头痛、呕吐、神志
意识障碍、抽搐、呼吸节律改变或偏瘫等。CT检查有助于以上诊断。
3.
肺水肿 是本病常见的合并症,临床上有两种情况。
(1)急性呼吸窘迫综合征(ARDS):这是肺毛细
血管损伤,通透性增高使肺间质大量渗液,此外肺内微小血管的
血栓形成和肺泡表面活性物质生成减少均能促成ARDS。临床表现为呼吸急促,30~40次/min。早期没有明显发绀和肺部啰音,中期可出现发绀,肺都可闻及支气管呼吸音和干湿啰音。X线胸片,可见双侧斑点状或片状阴影,肺野外带阴影浓,而边缘薄,呈毛玻璃样。血气分析动脉氧分压(Pa0
2)降低至8.0kPa(60mmHg)以下,并进行性降低。肺泡动脉分压明显增高,达4.0kPa(30mmHg)以上。常见于休克期和少尿期。新近美国报告发生在新墨西哥州等地的
汉坦病毒肺综合征,以ARDS为主要表现。常于发病第2~6天内因呼吸窘迫导致
急性呼吸衰竭而死亡。
(2)心力衰竭:可以由肺毛细血管受损,肺泡内大量渗液所致,亦可由高容量或心肌受损所引起,主要表现为呼吸增快,咳泡沫样粉红色痰,发绀和满肺啰音。
4.
胸腔积液和
肺不张 普马拉病毒引起的出血热多见,Kanerva对125例PUUV引起的HFRS患者进行检查,发现28%的患者存在胸膜积液或
肺不张,而
肺水肿罕见。这些患者均有较明显的低蛋白血症,因而认为毛细血管漏出及炎症可能是肺部异常的原因。
5.继发感染 多见于少尿期和多尿早期,以肺部和泌尿系感染以及
败血症多见,为免疫功能下降和导尿等操作所致,易引起继发性休克而使病情加重。
6.
自发性肾破裂 多发生于少尿期,由于严重肾髓质出血所致。常因恶心、呕吐或咳嗽等,使腹腔或胸腔压力突然升高,引起肾血管内压力升高而促进出血。突然坐起或翻身,使腰大肌急剧收缩,肾脏受挤压亦易引起肾破裂。临床表现为患者突感腰部或腹部剧痛,严重者血压下降,冷汗淋漓。若血液渗入腹腔,可出现腹膜刺激征,腹穿有鲜血。B超检查能发现肾周围及腹腔包块中有液平段。如能及时手术能降低病死率。
7.心脏损害和心力衰竭 汉坦病毒能侵犯心肌,而引起心肌损害,临床上常见为心动过缓和
心律失常。由于高血容量综合征、
肺水肿等使心肌负担过重,因而可出现心力衰竭。
8.肝损害 4%~60%患者ALT升高,少数患者出现
黄疸或明显肝功能损害,肝损害以SEOV感染多见。是病毒损害肝脏所致。
9.高渗性非酮症
昏迷 极少数HFRS患者在少尿期或多尿期出现表情淡漠、反应迟钝、嗜睡甚至
昏迷。检查血糖明显升高,常大于22.9~33.6mmol/L,血钠>145mmol/L,尿酮阴性,血浆渗透压>350mmol/L。这是HFRS患者胰腺β细胞受病毒侵犯使胰岛素分泌减少,或过量使用糖皮质激素、静脉补糖、补钠过多和过度利尿导致
脱水所致。
 实验室检查
实验室检查
实验室检查:
1.血常规
(1)白细胞计数:第1~2病日多属正常,第3病日后逐渐升高,可达(15~30)×109/L。少数重症患者可达(50~100)×109/L。
(2)白细胞分类:发病早期中性粒细胞增多,核左移,有中毒颗粒。重症患者可见幼稚细胞呈类白血病反应。第4~5病日后,淋巴细胞增多,并出现较多的异型淋巴细胞。由于异型淋巴细胞在其他病毒性疾病时亦可出现,因此不能作为疾病诊断的主要依据。
(3)
血红蛋白和红细胞:由于血浆外渗,导致血液浓缩,所以从发热后期开始至低血压休克期,
血红蛋白和红细胞数升高,可达150g/L和5.0×10
12/L以上。
(4)血小板从第2病日起开始减少,一般在(50~80)×109/L左右,并可见异型血小板。
2.尿常规
(1)尿蛋白:第2病日即可出现,第4~6病日尿蛋白常达 或 。突然出现大量尿蛋白,对诊断很有帮助。部分病例尿中出现膜状物,这是大量尿蛋白与红细胞和脱落上皮细胞相混合的凝聚物。
(2)显微镜检:可见红细胞、白细胞和管型。此外尿沉渣中可发现巨大的融合细胞,这是EHF病毒的包膜糖蛋白在酸性条件下引起泌尿系脱落细胞的融合。这些融合细胞中能检出EHF病毒抗原。
3.血液生化检查
(1)血
尿素氮及肌酸酐:多数患者在低血压休克期,少数患者在发热后期,
尿素氮和肌酸酐开始升高,移行期末达高峰,多尿后期开始下降。
(2)血酸碱度:发热期血气分析以呼吸性碱中毒多见,这与发热及换气过度有关。休克期和少尿期以代谢性酸中毒为主。
(3)电解质:血钠、氯、钙在本病各期中多数降低,而磷、镁等则增高,血钾在发热期、休克期处于低水平,少尿期升高,多尿期又降低。但亦有少数患者少尿期仍出现低血钾。
(4)凝血功能:发热期开始血小板减少,其黏附、凝聚和释放功能降低。若出现DIC血小板常减少至50×10
9/L以下。DIC的高凝期出现
凝血时间缩短。消耗性低凝血期则
纤维蛋白原降低,凝血酶原时延长和
凝血酶时间延长。进入纤溶亢进期则出现纤维蛋白降解物(FDP)升高。
4.特殊检查
(1)病毒分离:发热期患者的血清、血细胞和尿液等标本接种Vero-E6细胞或A549细胞中,可分离出汉坦病毒。
(2)抗原检查:早期患者的血清、外周血的中性粒细胞、淋巴细胞和单核细胞,以及尿和尿沉渣细胞,应用汉坦病毒的多克隆或单克隆抗体,可检出汉坦病毒抗原。常用免疫荧光或ELISA法,胶体金法则更为敏感。
(3)特异性抗体检测:包括血清中检测特异性IgM或IgG抗体。IgM抗体1∶20为阳性,发病第2天即能检出。IgG 1∶40为阳性,1周后滴度上升4倍有诊断价值。目前认为核蛋白抗体的检测,有利于早期诊断,而G2抗体的检测,则有利于预后判断。新近国外研究免疫色谱快速试验以重组核蛋白(NP)为抗原来检测患者的IgM抗体5min能出结果,敏感性和特异性均为100%。
(4)PCR技术:应用RT-PCR方法检测汉坦病毒RNA,敏感性高,可作早期诊断。
 其他辅助检查
其他辅助检查
其他辅助检查:
1.肝功能 血清
丙氨酸转氨酶(ALT)约50%左右患者升高,少数患者血清胆红素升高。
2.心电图 可出现窦性心动过缓,传导阻滞等心律失常和心肌受损表现。此外高血钾时出现T波高尖,低血钾时出现U波等。
3.眼压和眼底 部分患者眼压增高,眼压明显增高者常预示为重症。脑水肿患者可见视盘水肿和静脉充血、扩张。
4.胸部X线 约30%患者有肺水肿、淤血表现,约20%患者出现胸腔积液和胸膜反应。
 诊断
诊断
诊断:诊断依据依靠临床特征性症状和体征,结合实验室检查,参考流行病学史进行诊断。
1.流行病学资料 包括发病季节,病前2个月内进入疫区并有与鼠类或其他宿主动物接触史。
2.临床表现 包括早期3种主要表现(发热中毒症,充血、出血、外渗征、肾损害)和病程的五期经过。典型病例有发热期、
低血压休克期、少尿期、多尿期和恢复期的5期经过;不典型者可以越期或前3期之间重叠。
3.实验室检查 包括血液浓缩,血红蛋白和红细胞计数增高。白细胞计数增高,和血小板减少。尿蛋白大量出现和尿中排出膜状物等有助于诊断。血清、血细胞和尿液中检出汉坦病毒抗原和血清中检出特异性IgM抗体,可以确诊。特异性1gG抗体需双份血清效价升高4倍以上者有诊断意义。新近开展的聚合酶链反应(PCR)检测汉坦病毒的RNA,有助于早期和非典型患者的诊断。
 鉴别诊断
鉴别诊断
 治疗
治疗
治疗:本病治疗以综合疗法为主,早期应用抗病毒治疗,中晚期则针对病理生理进行对症治疗。“三早一就地"仍然是本病治疗原则。即早期发现,早期休息,早期治疗和就近治疗。治疗中要注意防治休克,肾衰竭和出血。
1.发热期 治疗原则:抗病毒,减轻外渗,改善中毒症状和预防DIC。
(1)抗病毒:发病4天以内患者,可应用利巴韦林1g/d加入10%
葡萄糖注射液中静脉滴注,持续3~5天进行抗病毒治疗。根据我们和西安医科大学的经验,利巴韦林治疗组在退热、尿蛋白消失、血小板上升和越期等方面明显优于对照组。此外我们还进行粒细胞内汉坦病毒抗原检测,发现利巴韦林应用3天后,粒细胞中汉坦病毒抗原明显低于对照组。说明利巴韦林早期治疗能抑制病毒、减轻病情和缩短病程。
(2)减轻外渗:应早期卧床休息,为降低血管通透性可给予
芦丁,维生素C等。输注平衡盐注射液1000ml/d左右。高热、大汗或呕吐、腹泻者可适当增加。发热后期给予20%甘露醇注射液125~250ml,以提高
血浆渗透压,减轻外掺和织水肿。
(3)改善中毒症状:高热以物理降温为主。忌用强烈发汗退热药,以防大汗而进一步丧失血容量。中毒症状重者可给予地塞米松5~10mg静脉滴注。呕吐频繁者给予甲氧氯普胺注射液10mg肌内注射。
(4)预防DIC:给予
右旋糖酐40葡萄糖注射液500ml或
丹参注射液40~60 g/d静脉滴注,以降低血液黏滞性。高热、中毒症状和渗出征严重者,应定期检测凝血时间。试管法3min以内或活化部分凝血活酶时间(APTT)34s以内为高凝状态,可给予小剂量
肝素抗凝,一般用量0.5~1mg/kg体重,1次/6~12h缓慢静脉注射再次用药前宜作凝血时间,若试管法凝血时间>25min,应暂停1次。疗程1~3天。
2.低血压休克期 治疗原则:积极补容,注意纠酸。
(1)补充血容量:宜早期、快速和适量。即出现低血压倾向时就应早期补充血容量。要适量,避免补液过多引起肺水肿、心力衰竭。液体应晶胶结合,以平衡盐为主,切忌单纯输入
葡萄糖注射液。因为输入的
葡萄糖在体内氧化后即为低渗水溶液,很快透过受损的血管渗入周围组织,不能达到补容目的。平衡盐溶液所含电解质,酸碱度和渗透压与人体细胞外液相似,有利于体内电解质和酸碱平衡。常用的
复方醋酸钠注射液,每升含
氯化钠5.85g、
氯化钙0.33g、
醋酸钠6.12 g、
氯化钾0.3g,即含钠145mmol/L,钾4mmol/L,氯108.5mmol/L,钙2.25mmoL/L 。
根据我们的经验,对休克较重患者,应用双渗平衡盐溶液(即每升各种电解质含量加1倍)能达到快速补容目的。这是由于输入高渗液体后,使外渗于组织的体液回流血管内,从而达到快速扩容。胶体溶液常用
右旋糖酐40,甘露醇,
血浆和
人血白蛋白。10%
右旋糖酐40的渗透压为
血浆1.5倍,除扩容作用外尚有防止红细胞和血小板在血管壁凝聚,达到改善微循环作用。输入量不宜超过1000m1/d,否则易引起出血。20%甘露醇注射液为高渗溶液,能起明显扩容作用。对于严重或顽固性休克,由于
血浆大量外渗,宜补充
血浆或
人血白蛋白。但本期存在血液浓缩,因而不宜应用全血。
补容方法:出现低血压时可输注等渗平衡盐注射液。若出现明显休克时,宜快速静脉滴注或推注双渗平衡盐注射液或20%甘露醇注射液,血压上升后应用
右旋糖酐40或等渗平衡盐溶液维持。严重休克者适量补充血制品,补容期间应密切观察血压变化,血压正常后输液仍需维持24h以上。
(2)纠正酸中毒:休克引起组织脏器血液灌注不足,氧化过程障碍,乳酸形成增多,导致代谢性酸中毒,若不进行纠酸,易诱发DIC,且能降低心肌收缩力和血管对血管活性物质的反应性,不利于休克的纠正。纠酸主要用5%碳酸氢钠注射液,可根据
二氧化碳结合力结果分次补充,或60~80ml/次,根据病情给予1~4次/d。由于5%碳酸氢钠注射液渗透压为
血浆的4倍,不但能纠酸尚有扩容作用。
(3)血管活性药和肾皮质激素的应用:经补液,纠酸后血红蛋白已恢复正常,但血压仍不稳定者,可应用血管活性药物如多巴胺100~200mg/L静脉滴注,具有扩张内脏血管和增强心肌收缩作用。山莨菪碱具有扩张微血管解除血管痉挛作用,可应用0.3~0.5mg/kg静脉滴注。肾上腺皮质激素具有保持血管完整性,减少外渗,减低外周血管阻力,改善微循环作用,此外能稳定细胞膜及溶酶体膜,减轻休克对脏器实质细胞损害作用,常用地塞米松10~20mg,静脉滴注。
3.少尿期 治疗原则为“稳、促、导、透”。即稳定机体内环境,促进利尿,导泻和透析治疗。
(1)稳定机体内环境:
①维持水和电解质平衡:由于部分患者少尿期与休克期重叠,因此少尿早期需与休克所致的肾前性少尿相鉴别。若尿相对密度>1.20,尿钠<40mmol/L,尿尿素氮与血尿素氮之比>10∶1,应考虑肾前性少尿。可输注电解质溶液500~1000ml,并观察尿量是否增加。亦可用20%甘露醇注射液100~125ml,推注,观察3h若尿量不超过100m1,则为肾实质损害所致少尿,宜严格控制输入量。每天补液量为前1天尿量和呕吐量再加500~700ml。少尿期电解质紊乱主要是高血钾,因此不宜补充钾盐,但少数患者可出现低血钾,故应根据血钾和心电图的结果,适量补充。
②减少蛋白质分解,控制氮质血症:给予高糖类、高维生素和低蛋白质饮食。不能进食者静脉滴注
葡萄糖200~300g/d,可加入适量胰岛素。由于需控制输液量,因此
葡萄糖宜用20%~25%高渗溶液。
③维持酸碱平衡:本期常伴代谢性酸中毒,因此需根据
二氧化碳结合力结果,应用5%碳酸氢钠注射液纠正酸中毒。不能作
二氧化碳结合力检测时,可给予5%碳酸氢钠注射液50~80ml静脉滴注,纠酸后仍有呼吸深大和增快的库斯莫尔大呼吸,则需继续纠酸。
(2)促进利尿:本病少尿的原因之一是肾间质水肿压迫肾小管,因此少尿初期可应用20%甘露醇注射液125ml静脉注射,以减轻肾间质水肿。用后若利尿效果明显者可重复应用1次,但不宜长期大量应用。常用利尿药物为呋塞米,可以小量开始,逐步加大剂量至100~300mg/次,直接静脉注射,效果不明显时尚可适当加大剂量,4~6h重复1次。亦可应用血管扩张剂如酚妥拉明10mg或山莨菪碱10~20mg静脉滴注,2次/d或3次/d,少尿早期亦可应用普萘洛尔口服。
(3)导泻和放血疗法:为预防高血容量综合征和高血钾,可以进行导泻,以通过肠道排出体内多余的水分和钾离子,但必须是无消化道出血者。常用甘露醇25g,2次/d或3次/d,口服;亦可用50%
硫酸镁溶液40ml或
大黄10~30g煎水,2次/d或3次/d,口服。放血疗法目前已少用,对少尿伴高血容量综合征所致肺水肿、心力衰竭患者,可以放血300~400ml。
(4)透析疗法:目前常用腹透析和血液透析。前者由于透析管的改进,目前应用带环的硅胶透析管,可以防止因透析管固定不牢而引起腹膜感染,因简而易行适用于基层单位。后者需人工肾的专门设备。
①透析疗法的适应证:少尿持续4天以上或无尿24 h以上,并存在以下情况之一者。A.尿素氮>28.56mmol/L;B.高分解状态,尿素氮每天升高>7.14mmol/L。C.血钾>6mmol/L。心电图有高耸T波的高钾表现;D.高血容量综合征或伴肺水肿者;E.极度烦躁不安或伴脑水肿者。
②腹膜透析这是利用腹膜是半透膜具有扩散、渗透等功能,可以清除体内氮质及其他废物的原理:A.切口:采取脐下3~5cm切口,插管;B.调整透析液成分:常用透析液每升含
氯化钠5.6g、
氯化钙0.26g、氯化镁0.15g、
乳酸钠5g、
葡萄糖15g,渗透压为364mmol/L。为预防感染每升透析液可加
庆大霉素4万U。高血容量综合征、肺水肿或脑水肿患者为脱水每升透析液可加5%
葡萄糖注射液40~45ml;C.透析液灌注:冬春季透析液需加温至37.5~38℃,每次灌注1000ml,40min后放出,每天灌注7~8次;D.观察:注意观察体温,腹部有无压痛,透析液颜色和血尿素氮情况。如腹腔放出的透析液呈混浊状,含蛋白量较高,为防止纤维蛋白阻塞导管,每升透析液可加入
肝素50mg。
③血液透析:根据血尿素氮情况每2~3天透析1次,每次5~6h。透析终止时间:尿量达2000ml/d以上,尿素氮下降,高血容量综合征或脑水肿好转后可以停止透析。
4.多尿期治疗原则 移行期和多尿早期的治疗同少尿期。多尿后期主要是维持水和电解质平衡,防治继发感染。
(1)维持水与电解质平衡:给予半流质和含钾食物。水分补充以口服为主,不能进食者可以静脉注射。
(2)防治继发感染:由于免疫功能下降,本期易发生呼吸道和泌尿系感染,因此需注意口腔卫生,必要时作室内空气消毒。发生感染后应及时诊断和治疗,忌用对肾脏有毒性作用的抗生素。
5.恢复期 治疗原则为补充营养,逐步恢复工作。出院后应休息1~2个月。定期复查肾功能、血压和垂体功能。如有异常应及时治疗。
6.合并症治疗
(1)消化道出血:应注意病因治疗,如为DIC消耗性低凝血期,宜补充凝血因子和血小板,可给予含凝血因子的冷沉淀和血小板悬液。如为DIC纤溶亢进期,可应用
氨基己酸1g或
氨甲苯酸200~400mg静脉滴注,2次/d或3次/d。若是
肝素类物质增高所致出血,则用
硫酸鱼精蛋白(
鱼精蛋白)50~100mg/次,加入5%
葡萄糖注射液中静脉缓慢注射1次/d或2次/d亦可用甲苯胺蓝3~5mg/(kg·d),口服或静脉注射。局部治疗可应用
凝血酶4000U用生理盐水100ml稀释后口服,2次/d或3次/d。
(2)中枢神经系统并发症:出现抽搐时应用地西泮10~20m/次,静脉注射或
异戊巴比妥钠0.2~0.4g用生理盐水稀释为20ml后静脉注射。脑水肿或颅内出血所致颅内高压,应用甘露醇1~2g/kg体重,静脉推注,每4~6小时1次。少尿期不宜应用甘露醇可用10%甘油盐水0.5~1.0g/kg体重,静脉缓注,降颅内压作用可维持3~4h。切忌太大剂量或输入速度过快,以免发生溶血或肾损害。必要时作透析治疗,应用高渗透析液脱水。
(3)ARDS:肾皮质激素能减轻血管渗透性,减少肺部渗出,促进肺泡表面物质合成和分泌,抑制
组胺、5-羟色胺和慢反应物质的合成和释放,缓解支气管平滑肌痉挛,一般应用泼尼松100~250mg/d,口服,或地塞米松20~30mg,1次/8 h,静脉注射。此外,应限制入水量和进行高频通气或应用呼吸机进行人工呼气末正压呼吸(PEEP)。呼吸机要与氧疗密切配合,可以减轻心脏负担。呼吸机的应用仅为缓解呼吸衰竭、延长生命为ARDS治疗赢得时间。新近有报告应用体外膜式人工氧合法(extracorporealmembrane oxygenation,ECMO)来治疗ARDS,并获得较好疗效。
(4)心力衰竭肺水肿:应停止或控制输液,应用
去乙酰毛花苷C(
西地兰)强心,地西泮镇静,以及扩张血管和利尿药物。若为少尿或无尿,应进行导泻或透析治疗。
(5)自发性肾破裂进行手术缝合。
(6)高渗性非酮症昏迷:低血压休克期应补充0.45%低渗盐水和补充
人血白蛋白或
血浆,以维持血容量,此外应用胰岛素降低血糖,待
血浆渗透压下降至330mmol/L.后再按常规补容。多尿期除应用低渗溶液和胰岛素外,应注意补钾。
 预后
预后
预后:本病病死率与病型轻重、治疗迟早及措施是否正确有关。近年来通过早期诊断和治疗措施的改进,病死率由10%下降为5%以下。在我国一般认为汉坦型病毒感染病死率高于汉城型病毒感染。重型病人的病死率仍较高。主要死亡原因是休克、尿毒症、
肺水肿、出血(主要是
脑出血和肺出血等)。由于治疗措施得当,因休克、尿毒症、
肺水肿等而死亡的病例逐渐减少,而死于出血的病例相对增多。本病患者恢复期后仍可出现慢性肾功能损害、高血压或腺垂体功能减退,说明预后不良。
 预防
预防
预防:
1.疫情监测 由于新疫区不断扩大,因此应作好鼠密度、鼠带病毒率和易感人群的监测工作。
2.防鼠灭鼠 应用药物、机械等方法灭鼠,一般认为灭鼠后汉城病毒所致EHF的发病率能较好地控制和下降。
3.作好食品卫生和个人卫生 防止鼠类排泄物污染食品,不用手接触鼠类及其排泄物。动物实验时要防止被大、小白鼠咬伤。
4.疫苗注射 目前我国研制的沙鼠肾细胞灭活疫苗(汉坦型)、地鼠肾细胞灭活疫苗(汉城型)和乳鼠脑纯化汉坦病毒灭活疫苗。均已在临床试用。经0天、7天、28天或0月、1月、2月、三次各注射疫苗1ml后,80%~100%能产生中和抗体。但持续3~6个月后明显下降,1年后需加强注射。关于基因重组疫苗,国外研究应用重组PUUV。核壳蛋白(NP)疫苗在动物试验中能获得完全保护,应用汉坦病毒及汉城病毒M基因的G1和G2 DNA疫苗在动物中能产生高水平的中和抗体。Meclain等应用汉坦病毒M和S片段克隆的重组疫苗进行Ⅰ、Ⅱ期临床试验表明重组疫苗是安全的,健康志愿者经两次注射后能产生较高的中和抗体。在我国重组疫苗亦在研究中。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防